燃料電池を検証する
更新が遅くなり、申し訳ない。物理的に忙しくて...
最近、何かと燃料電池が注目されている。燃料電池は、水の電気分解の逆の化学反応を行い、その過程で電気を起こす発電装置だ。エネルギー変換効率が大変良く、水素と酸素を燃料とし、廃棄物として出てくるのは水だけなので環境保全面でも芳しい。酸素は空気中にいくらでもあるし、水素も色んなところから取り出せる。その気になれば、自動車にも載せられるかも知れないってことで、将来は電気自動車のエネルギー源としても注目を浴びているのだ。
そんな燃料電池の仕組みを検証してみた。
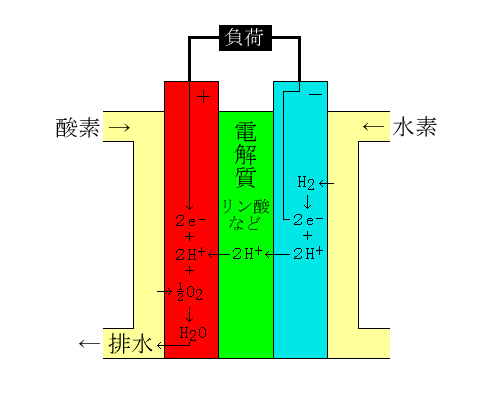
図が燃料電池の基本構造だ。図のように、2本の電極(赤と青)の間に何らかの電解質をはさみ、電極の周りに水素と酸素を流す。すると、以下のような化学反応が起こる。
H2 → 2H+ + 2e-
水素は電子を遊離して水素イオンとなり、電解質へと移動。電子は電極(負荷)へ。
1/2O2 + 2H+ + 2e- → H2O
酸素は電解質から移動してきた水素イオンと電極(負荷)からの電子と反応して、水を生成。
ここで電子の流れが発生するから、その逆方向、つまり図の+極から−極に電流が流れるわけだ。これが、燃料電池の原理である(違ってたら指摘してね)。なーんだ、簡単じゃねーか。
そんなに簡単なんだったら作られるかも〜
ってことで、色々と考えてみた。
要は水素と酸素と電解質と電極とがあれば、燃料電池はできてしまうのである。しかし、それらをどう調達するかが問題だ。できれば、家庭にあるようなものでやりたい。だから、ガスのボンベや、変な薬品類は使いたくない。
そこで、無いものは作っちゃう。水素や酸素は水を電気分解したら作られるものだから、それをどうにかして捕まえればよいことだ。まあ、燃料電池は水の電気分解の逆反応なんだから、当然なんだが。それだったら電池なんか作る意味なんかないじゃないかー、ってことには気付かなかったことにして、ツッコミなどは間違っても入れないように。とにかく、これはどうにかなりそうだ。
次に、電解質だ。燃料電池を作るのにも、水の電気分解を行うにも、これがどうしても必要となる。水酸化ナトリウムや水酸化カリウムが理想的だが、そのようなものは普通の家庭には無いだろう。あるものと言えば、食塩ぐらいか。しかし、それじゃ電気分解すると塩素がでるから、あまり良いとは言えない。家にあったものでミョウバンもやってみたが、良いとは言えなかった。
やむなく水酸化ナントカを使うのであれば、街の薬局でも買えないことはないが、お肌に良くない。薄い溶液ならばまだ良いが、溶液が濃くなくては電池の内部抵抗が大きくなって性能が落ちるはずだ。ある資料によると、燃料電池には11Nぐらいの水酸化カリウム液が良いらしいが、そんなものは素手では触れない。手を突っ込んで作業できるほうがやりやすいので、ちょっと考える必要がある。
電極は適当なもので良いはずだ。しかし、水素と酸素の泡が付着するものが良いと思う。実験の電気分解では炭素棒を良く使うが、そんなものも家庭にはないだろうから、鉛筆の芯に凹凸をつけたようなものが良いのではなかろうか。
うーん、この辺まで考えて、まだ何も準備ができてないんだな。
だから、取り敢えず計画だけ書きました :-)
もどる
